Isomer hidrokarbon artinya kumpulan hidrokarbon yang mempunyai rumus mulekul yang sama namun berbeda bentuk/strukturnya.....
Contohnya :
Ada suatu gas hidrokarbon yang tergolong dalam alkana yang mempunyai rumus molekul C4H10, coba gambarkan kemungkinan bentuk kerangkanya...?
Coba kalian perhatikan kedua hidrokarbon di atas.....keduanya mempunyai rumus molekul C4H10 akan tetapi....setelah digambar dapat digambar terdapat dua kemungkinan bentuk, yakni yang gambar disebelah atas bernama : n-butana dan gambar bawahnya bernama : 3-metil propana. Keduanya merupakan alkana dengan jumlah atom C yang sama (dengan otomatis jumlah atom H nya juga sama.....)
contoh di atas itulah yang disebut isomer.......
Jenis isomer ada 2 yakni isomer struktur dan isomer geometri.....kemudian isomer struktur dibagi lagi menjadi 2 yakni isomer kerangka dan isomer fungsi. Demikian juga dengan isomer geometri, juga dibagi lagi menjadi 2 yakni isomer optik aktif dan isomer cis-trans.....
baiklah sekarang kita bahas aja satu persatu......
ISOMER STRUKTUR
isomer struktur disebabkan perbedaan ikatan antar unsur-unsur penyusunnya sehingga mempunyai bentuk yang berbeda.....
sebagai contoh akan saya sebutkan isomer dari C6H14 (alkana),
dalam menggambarkan isomer dari C6H14 hanya akan saya tulis ikatan antar atom C nya saja.... sedangkan atom H nya dapat kita tambahkan setelah suluruh isomer tergambar.... dengan ketentuan :
tanda ( - ) menunjukkan ikatan atom C tersebut dengan atom C lainnya.... jadi banyaknya tanda ( - ) menunjukkan banyaknya atom C lainnya yang diikat....karena jumlah ikatan dalam atom C maksimal 4 ikatan maka jumlah atom H yang diikat dapat ditentukan.....
- bila hanya terdiri dari satu tanda ( - ) maka atom C tersebut terletak di tepi.....dan mengikat 3 atom H.
- bila terdiri dari 2 tanda ( - ) berarti atom C ersebut terletak diantara rantai lurus....dan mengikat 2 atom H.
- bila terdiri dari 3 tanda ( - ) berarti atom C tersebut terletak pada percabangan yang berbentuk pertigaan....dan mengikat 1 atom H.
- dan....bila terdiri dari 4 tanda ( - ) berarti atom C persebut terletak pada percabangan yang berbentuk perempatan.....dan juga berarti tidak ada ikatan dengan atom H karena jumlah ikatan maksimal yakni 4 ikatan, sudah terpenuhi....
kembali lagi dalam penggambaran isomer dari alkana dengan rumus molekul C6H14, yaitu.....
Agar dalam penggambaran isomer di atas, tidak ada bentuk yang terlewatkan....saran saya gambarlah dari rantai lurusnya seperti dalam gambar pojok kiri atas....kemudian kalian gambar bentuk dengan satu cabang, dua cabang dan seterusnya....seperti gambar sebelah kiri atas ke bawah....kemudian dilanjutkan gambar kanan atas ke bawah....
bila dalam penggambaran isomer di atas jumlah yang kalian buat berbeda berarti ada beberapa kemungkinan kesalahan penggambaran....diantaranya sebagai berikut :
Kemungkinan kesalahan yang dapat terjadi dalam penggambaran isomer alkana di atas.......
- Cabang yang terletak di tepi..... ----> cabang tidak mungkin terletak di tepi, bila ada bentuk seperti cabang (benkok) di tepi....berarti sebenarnya itu merupakan rantai lurus.
- Penomoran cabang yang salah.....nomor cabang disebut dari ujung terdekat.
- Cabang yang lebih panjang dengan sisi rantai utama...---> cabang tidak mungkin lebih panjang dari sisi rantai utama....panjang cabang maksimal = panjang sisi rantai utama. (seperti gambar nomor 3 di atas...)
Untuk lebih mendalam....kita buat isomer dari Alkena dengan rumus molekul C6H12,yakni.....
Untuk menjaga agar tidak ada bentuk isomer yang terlewatkan....salah satunya dapat dilakukan dengan urutan penggambaran di atas....darigambar kiri atas ke bawah terus dilanjutkan ke gambar kanan atas ke bawah... yakni kita gambar rantai lurus dengan ikatan rangkap 2 nya di C nomor satu....kemudian kita gambar bentuk2 isomer yang bercabang satu dengan ikatan rangkap 2 nya tetap di C nomor satu....kemudian kita gambar bentuk2 isomer yang bercabang dua dengan ikatan rangkap 2 nya tetap di C nomor satu.... dan seterusnya, baru setelah berbagai bentuk isomer dengan ikatan rangkap 2 nya di nomor satu tergambar semua....kita gambar berbagai kemungkinan bentuk2 isomer yang rantai rangkap 2nya di nomor 2....dan seterusnya.
sebagai tambahan keterangan....coba kalian perhatikan gambar isomer sebelah kiri bawah....pada gambar tersebut cabang lebih panjang dari sisi rantai utama.....yakni cabang di C rangkap 2 sebelah kanan terdiri dari 2 atom C sedangkan sisi rantai utama sebelah kiri ikatan rangkap 2 hanya terdiri dari satu atom C...Apakah bentuk ini mungkin ??
Jawabannya :
mungkin.....karena dalam ikatan rangkap.... rantai utama harus mengandung ikatan rangkap...jadi penentuan rantai utama ditentukan dari ikatan rangkapnya itu sendiri....di sebelah kiri ikatan rangkap hanya ada satu kemungkinan.....yang terdiri dari satu atom C sedangkan di sebelah kanan ikatan rangkap ada dua kemungkinan.....yang kedua2nya sama panjangnya maka salah satunya sebagai cabang.
Bila jumlah penggambaran isomer berbeda dengan jumlah isomer di atas, berarti ada kemungkinan isomer yang belum tergambarkan atau terjadi kesalahan/penyebutan ganda...diantaranya sebagai berikut :
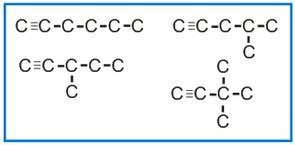
Satu contoh lagi bentu isomer dari Alkuna dengan rumus molekul C6H10,yakni.....
Ketiga contoh di atas merupakan contoh isomer struktur untuk Alakana, Alkena dan Alkuna......
PENGGOLONGAN ISOMER STRUKTUR
untuk Alkena dan Alkuna....karena mempunyai gugus fungsi ikatan rangkap 2 atau 3 maka bentuk isomer strukturnya dapat digolongkan lagi dalam dua jenis....
1. Isomer kerangka :
Isomer struktur yang mempunyai letak ikatan rangkap yang sama namun bentuk kerangka bangunnya berbeda. misalnya......
Semua isomer dari Alkuna di atas rantai rangkapnya sama2 terletak di C nomor satu.
2. Isomer Fungsi
Isomer struktur yang mempunyai bentuk kerangka yang sama namun ikatan rangkapnya berbeda. misalnya......
ISOMER GEOMETRI
Isomer geometri disebabkan oleh susunan atom dalam ruang. Jadi bila ada 2 senyawa hidrokarbon yang bentuk strukturnya sama, baik kerangkanya maupun letak gugus fungsionalnya sama, masih mungkin berbeda jenis jika susunan atom dalam ruangnya berbeda.....
untuk lebih jelasnya akan diuraikan dalam 2 masam bentuk isomer geometri di bawah ini :
ISOMER CIS-TRANS
Syarat utama terbentuk isomer Cis-Trans adalah terdapat ikatan rangkap dua ( C=C) yang tiap-tiap karbon (C) dalam ikatan rangkap tersebut mengikat atom atau gugus atom yang berbeda.
Untuk membedakan Alkena yang mempunyai isomer Cis-Trans atau tidak, perhatikanlah dua contoh senyawa di bawah ini :
1. CH2=CHCH3 ( n-propena) bila digambarkan bentuk strukturnya secara lengkap akan tampak sebagai berikut :
Coba kalian perhatikan bentuk di atas, atom karbon yang tepat berada di sebelah kanan ikatan rangkap selain mengikat C dengan ikatan rangkap juga mengikat 2 gugus yang berbeda yaitu - CH3 dan - H. Sedangkan atom karbon yang tepat berada di sebelah kiri ikatan rangkap mengikat 2 gugus yang sama yaitu - H. karena gugus yang diikat sama maka senyawa ini tidak mempunyai isomer Cis-Trans.
2. CH3CH=CHCH3 ( 2-butena) bila digambarkan bentuk strukturnya secara lengkap akan tampak seperti ini :
Kedua atom karbon yang mengikat ikatan rangkap tiap-tiap karbonnya baik yang sebelah kiri maupun yang sebelah kanan ikatan rangkap mempunyai dua gugus yang berbeda....yaitu -CH3 dan H. jadi perlu diperhatikan di sini, yang dimaksud mengikat gugus yang berbeda adalah pada tiap-tiap karbon yang berikatan rangkap.
Jadi bentuk senyawa di atas mempunyai isomer Cis-Trans yang digambarkan sebagai berikut :
Bila gugus yang sama dalam kedua karbon yang berikatan rangkap ( C=C ) terletak dalam satu sisi disebut Cis, sedangkan bila gugus yang sama dalam kedua karbon yang berikatan rangkap terletak berseberangan disebut trans.
ISOMER OPTIS AKTIF
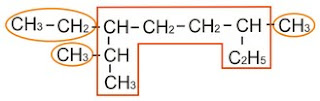
Isomer ini terbentuk karena adanya atom C kiral. C kiral adalah atom karbon yang mengikat 4 gugus yang berbeda. Coba kalian perhatikan gambar di bawah ini :
Pada gambar di atas terdapat C kiral, yakni yang diberi warna merah. Atom C tersebut mengikat 4 gugus yang berbeda, yakni atom hidrogen (H), metil (CH3-), etil (CH3-CH2-) dan propil (CH3-CH2-CH2-).
untuk memahami isomer ini dibutuhkan model 3 dimensi.....misalnya tangan kita. Walaupun bagian tangan kanan dan kiri kita sama namun secara keseluruhan berbeda...tangan kiri dan kanan satu sama lainnya ibarat bayangan cermin.