Dari berbagai unsur-unsur kimia yang kita kenal....ada satu unsur yang cakupannya sangat luas dan pembahasannya sangat mendalam yakni KARBON. Karbon mempunyai nomor atom 6 sehingga jumlah elektronnya juga 6....dengan konfigurasi 6C = 2, 4. Dari konfigurasi elektron ini terlihat atom C mempunyai 4 elektron valensi (elektron pada kulit terluar).....Untuk memperoleh 8 elektron (oktet) pada kulit terluarnya (elektron valensi) dibutuhkan 4 elektron sehingga masing-masing elektron valensi mencari pasangan elektron dengan atom-atom lainnya. Kekhasan atom karbon adalah kemampuannya untuk berikatan dengan atom karbon yang lain membentuk rantai karbon. Bentuk rantai2 karbon yang paling sederhana adalah Hidrokarbon. Hidrokarbon hanya tersusun dari dua unsur yaitu Hidrogen dan Karbon.
Berdasarkan jumlah atom C lain yang terikat pada satu atom C dalam rantai karbon, maka atom C dibedakan menjadi :
a. Atom C primer, yaitu atom C yang mengikat satu atom C yang lain.
b. Atom C sekunder, yaitu atom C yang mengikat dua atom C yang lain.
c. Atom C tersier, yaitu atom C yang mengikat tiga atom C yang lain.
d. Atom C kwarterner, yaitu atom C yang mengikat empat atom C yang lain.
• atom C primer, atom C nomor 1, 7, 8, 9 dan 10 (warna hijau)
• atom C sekunder, atom C nomor 2, 4 dan 6 (warna biru)
• atom C tersier, atom C nomor 3 (warna kuning)
• atom C kwarterner, atom C nomor 5 (warna merah)
Berdasarkan bentuk rantai karbonnya :
• Hidrokarbon alifatik = senyawa hidrokarbon dengan rantai lurus/terbuka yang jenuh (ikatan tunggal/alkana) maupun tidak jenuh (ikatan rangkap/alkena atau alkuna).
• Hidrokarbon alisiklik = senyawa hidrokarbon dengan rantai melingkar / tertutup (cincin).
• Hidrokarbon aromatik = senyawa hidrokarbon dengan rantai melingkar (cincin) yang mempunyai ikatan antar atom C tunggal dan rangkap secara selang-seling / bergantian (konjugasi)
Selanjutnya dalam artikel ini saya batasi membahas hidrokarbon rantai terbuka (alifatik) saja....
Berdasarkan ikatan yang ada dalam rantai C-nya, senyawa hidrokarbon alifatik dibedakan atas :
1. Alkana (CnH2n+2)
2. Alkena (CnH2n)
3. Alkuna (CnH2n-2)
Keterangan : n = 1, 2, 3, 4, .......dst
Alkana (Parafin)
adalah hidrokarbon yang rantai C nya hanya terdiri dari ikatan kovalen tunggal saja. sering disebut sebagai hidrokarbon jenuh....karena jumlah atom Hidrogen dalam tiap2 molekulnya maksimal. Memahami tata nama Alkana sangat vital, karena menjadi dasar penamaan senyawa2 karbon lainnya.
Sifat-sifat Alkana
- Hidrokarbon jenuh (tidak ada ikatan atom C rangkap sehingga jumlah atom H nya maksimal)
- Disebut golongan parafin karena affinitas kecil (sedikit gaya gabung)
- Sukar bereaksi
- Bentuk Alkana dengan rantai C1 – C4 pada suhu kamar adalah gas, C4 – C17 pada suhu adalah cair dan > C18 pada suhu kamar adalah padat
- Titik didih makin tinggi bila unsur C nya bertambah...dan bila jumlah atom C sama maka yang bercabang mempunyai titik didih yang lebih rendah
- Sifat kelarutan : mudah larut dalam pelarut non polar
- Massa jenisnya naik seiring dengan penambahan jumlah unsur C
- Merupakan sumber utama gas alam dan petrolium (minyak bumi)
Rumus umumnya CnH2n+2
Deret homolog alkana
Deret homolog adalah suatu golongan/kelompok senyawa karbon dengan rumus umum yang sama, mempunyai sifat yang mirip dan antar suku-suku berturutannya mempunyai beda CH2 atau dengan kata lain merupakan rantai terbuka tanpa cabang atau dengan cabang yang nomor cabangnya sama.
Sifat-sifat deret homolog alkana :
o Mempunyai sifat kimia yang mirip
o Mempunyai rumus umum yang sama
o Perbedaan Mr antara 2 suku berturutannya sebesar 14
o Makin panjang rantai karbon, makin tinggi titik didihnya
n Rumus Nama
1. CH4 = metana
2 . C2H6 = etana
3 . C3H8 = propana
4. C4H10 = butana
5. C5H12 = pentana
6. C6H14 = heksana
7. C7H16 = heptana
8. C8H18 = oktana
9. C9H20 = nonana
10. C10H22 = dekana
11. C11H24 = undekana
12. C12H26 = dodekana
TATA NAMA ALKANA
1. Nama alkana didasarkan pada rantai C terpanjang sebagai rantai utama. Apabila ada dua atau lebih rantai yang terpanjang maka dipilih yang jumlah cabangnya terbanyak
2. Cabang merupakan rantai C yang terikat pada rantai utama. di depan nama alkananya ditulis nomor dan nama cabang. Nama cabang sesuai dengan nama alkana dengan mengganti akhiran ana dengan akhiran il (alkil).
3. Jika terdapat beberapa cabang yang sama, maka nama cabang yang jumlah C nya sama disebutkan sekali tetapi dilengkapi dengan awalan yang menyatakan jumlah seluruh cabang tersebut. Nomor atom C tempat cabang terikat harus dituliskan sebanyak cabang yang ada (jumlah nomor yang dituliskan = awalan yang digunakan), yaitu di = 2, tri = 3, tetra =4, penta = 5 dan seterusnya.
4. Untuk cabang yang jumlah C nya berbeda diurutkan sesuai dengan urutan abjad ( etil lebih dulu dari metil ).
5. Nomor cabang dihitung dari ujung rantai utama yang terdekat dengan cabang. Apabila letak cabang yang terdekat dengan kedua sama dimulai dari :
• Cabang yang urutan abjadnya lebih dulu ( etil lebih dulu dari metil )
• Cabang yang jumlahnya lebih banyak ( dua cabang dulu dari satu cabang )
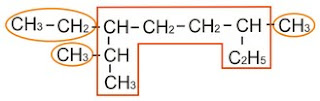
Contoh :
Apakah nama idrokarbon di bawah ini ?
pertama kali kita tentukan rantai utamanya.....Rantai utama adalah rantai terpanjang :
rantai utamanya adalah yang di kotak merah...... Kenapa?? coba kalian perhatikan sisi sebelah kiri, bila rantai utamanya yang lurus (garis putus2) maka sama2 akan bertambah 2 atom C tapi hanya akan menimbulkan satu cabang (bagian yang belok ke bawah)....sedangkan bila kita belokkan ke bawah akan timbul 2 cabang (Aturan no 1). Sekarang coba kalian perhatikan bagian kanan, penjelasannya lebih mudah....bila rantai utamanya yang lurus (garis putus2) hanya bertambah satu atom C sedangkan bila belok ke bawah maka akan bertambah 2 atom C. Jadi rangkaian rantai utama itu boleh belak-belok dan gak harus lurus......asal masih dalam satu rangkaian yang bersambungan tanpa cabang.
rantai karbon yang tersisa dari rantai utama adalah cabangnya.....
terlihat ada 3 cabang yakni 1 etil dan 2 metil.....penomoran cabang kita pilih yang angkanya terkecil :
• bila dari ujung rantai utama sebelah kiri maka etil terletak di atom C rantai utama nomor 3 dan metil terletak di atom C rantai utama nomor 2 dan 6
• bila dari ujung rantai utama sebelah kanan maka etil terletak di atom C rantai utama nomor 6 dan metil di atom C rantai utama nomor 3 dan 7
kesimpulannya kira urutkan dari ujung sebelah kiri.....
Urutan penamaan : nomor cabang - nana cabang - nama rantai induk
jadi namanya : 3 etil 2,6 dimetil oktana
cabang etil disebut lebih dahulu daripada metil karena abjad nama depannya dahulu (abjad "e" lebih dahulu dari "m"). karena cabang metil ada dua buah maka cukup disebut sekali ditambah awalan "di" yang artinya "dua". karena rantai utamanya terdiri dari 8 atom C maka rantai utamanya bernama : oktana.
bentuk struktur kerangka Alkana kadangkala mengalami penyingkatan.....misalnya :
CH3 (warna hijau) merupakan ujung rantai
CH2 (warna biru) merupakan bagian tenganh rantai lurus
CH (warna oranye) percabangan tiga
C (warna merah) percabangan empat
Kegunaan alkana, sebagai :
• Bahan bakar
• Pelarut
• Sumber hidrogen
• Pelumas
• Bahan baku untuk senyawa organik lain
• Bahan baku industri
Alkena (Olefin)
merupakan senyawa hidrokarbon tak jenuh yang memiliki 1 ikatan rangkap 2 (-C=C-)
Sifat-sifat Alkena
- Hidrokarbon tak jenuh ikatan rangkap dua
- Alkena disebut juga olefin (pembentuk minyak)
- Sifat fisiologis lebih aktif (sbg obat tidur --> 2-metil-2-butena)
- Sifat sama dengan Alkana, tapi lebih reaktif
- Sifat-sifat : gas tak berwarna, dapat dibakar, bau yang khas, eksplosif dalam udara (pada konsentrasi 3 – 34 %)
- Terdapat dalam gas batu bara biasa pada proses “cracking”
Rumus umumnya CnH2n
TATA NAMA ALKENA
hampir sama dengan penamaan pada Alkana dengan perbedaan :
- Rantai utama harus mengandung ikatan rangkap dan dipilih yang terpanjang. Nama rantai utama juga mirip dengan alkana dengan mengganti akhiran -ana dengan -ena. Sehingga pemilihan rantai atom C terpanjang dimulai dari C rangkap ke sebelah kanan dan kirinya dan dipilih sebelah kanan dan kiri yang terpanjang.
- Nomor posisi ikatan rangkap ditulis di depan nama rantai utama dan dihitung dari ujung sampai letak ikatan rangkap yang nomor urut C nya terkecil.
- Urutan nomor posisi rantai cabang sama seperti urutan penomoran ikatan cabang rantai utama.
Contoh :
menpunyai rantai utama......
penghitungan atom C pada rantai utama dimulai dari ikatan rangkap....sebelah kiri ikatan rangkap hanya ada satu pilihan sedangkan sebelah kanan ikatan rangkap ada dua pilihan yaitu lurus dan belokan pertama ke bawah....kedua2nya sama2 menambah 4 atom C namun bila belokan pertama kebawah hanya menghasilkan satu cabang sedangkan bila lurus menimbulkan dua cabang.
Jadi namanya : 3 etil 4 metil 1 pentena
1 pentena dapat diganti dengan n-pentena atau khusus ikatan rangkap di nomor satu boleh tidak ditulis....sehingga namanya cukup : pentena. Nomor cabang diurutkan sama dengan urutan nomor ikatan rangkapnya. Pada soal di atas dari ujung sebelah kanan....
Kegunaan Alkena sebagai :
- Dapat digunakan sebagai obat bius (dicampur dengan O2)
- Untuk memasakkan buah-buahan
- bahan baku industri plastik, karet sintetik, dan alkohol.
Alkuna
merupakan senyawa hidrokarbon tak jenuh yang memiliki 1 ikatan rangkap 3 (–C≡C–). Sifat-nya sama dengan Alkena namun lebih reaktif.
Tata namanya juga sama dengan Alkena....namun akhiran -ena diganti -una
Kegunaan Alkuna sebagai :
- etuna (asetilena = C2H2) digunakan untuk mengelas besi dan baja.
- untuk penerangan
- Sintesis senyawa lain.
Alkil Halida (Haloalkana)
Senyawa alkil halida merupakan senyawa hidrokarbon baik jenuh maupun tak jenuh yang satu unsur H-nya atau lebih digantikan oleh unsur halogen (X = Br, Cl. I)
Sifat fisika Alkil Halida :
- Mempunyai titik lebih tinggi dari pada titik didih Alkana dengan jumlah unsur C yang sama.
- Tidak larut dalam air, tapi larut dalam pelarut organik tertentu.
- Senyawa-senyawa bromo, iodo dan polikloro lebih berat dari pada air.
Struktur Alkil Halida : R-X
Keterangan :
R = senyawa hidrokarbon
X = Br (bromo), Cl (kloro) dan I (Iodo)
Berdasarkan letak alkil dalam hidrokarbon di bagi menjadi :
- Alkil halida primer, bila diikat atom C primer
- Alkil halida sekunder, bila diikat atom C sekunder
- Alkil halida tersier, bila diikat atom C tersier
CH3-CH2-CH2-CH2-Cl (CH3)2CH-Br (CH3)3C-Br
Primer sekunder tersier
Pembuatan Alkil Halida
- Dari alkohol
- Halogenasi
- Adisi hidrogen halida dari alkena
- Adisi halogen dari alkena dan alkuna
reaksi adisi dapat dilihat dalam artikel saya yang berjudul "Reaksi-reaksi Senyawa Karbon"
Penggunaan Alkil Halida :
- Kloroform (CHCl3) : pelarut untuk lemak, obat bius (dibubuhi etanol, disimpan dalam botol coklat, diisi sampai penuh).
- Tetraklorometana = karbontetraklorida (CCl4) : pelarut untuk lemak, alat pemadam kebakaran (Pyrene).
- Freon (Freon 12 = CCl2F2, Freon 22 = CHCl2F) : pendingin lemari es, alat “air conditioner”, sebagai propellant (penyebar) kosmetik, insektisida, dsb.































 = dengan kata lain....ini adalah....ehm...zat itu....eh...dapat menyerap kalor ??
= dengan kata lain....ini adalah....ehm...zat itu....eh...dapat menyerap kalor ?? = kamu sangant fasih....
= kamu sangant fasih.... = hoo... delta T..??
= hoo... delta T..?? = Mmm.... delta T tu artinya perubahan suhu...(aq g bs nulis lambang "delta")
= Mmm.... delta T tu artinya perubahan suhu...(aq g bs nulis lambang "delta") = kita langsung bisa menghitung kalor air yang hilangg...
= kita langsung bisa menghitung kalor air yang hilangg...